Мир микророботов стремительно развивается, и на горизонте появляются инновационные решения, способные изменить многие аспекты медицины. Одним из удивительных направлений стала работа с естественными клетками человеческого и животного организма. В частности, сперматозоиды — уникальные пловцы, отличающиеся маневренностью и скоростью — оказались отличной платформой для создания биологических микророботов. Они способны действовать в сложной среде и идеально подходят для транспортировки лекарств или осуществления целевых медицинских задач на микроуровне внутри человеческого тела.
Но, несмотря на природные преимущества, сперматозоиды почти не видны современным неинвазивным диагностическим методам. Их прозрачность и низкая плотность делают невозможным наблюдение за их поведением в глубине тканей привычными средствами медицинской визуализации. Это долго сдерживало их реальное применение в биоинженерии. Недостаточная визуализация не позволяла управлять движением клеточных микророботов с точностью и безопасностью, нужными для медицинских процедур.
Как наночастицы оксида железа раскрывают потенциал сперматозоидов
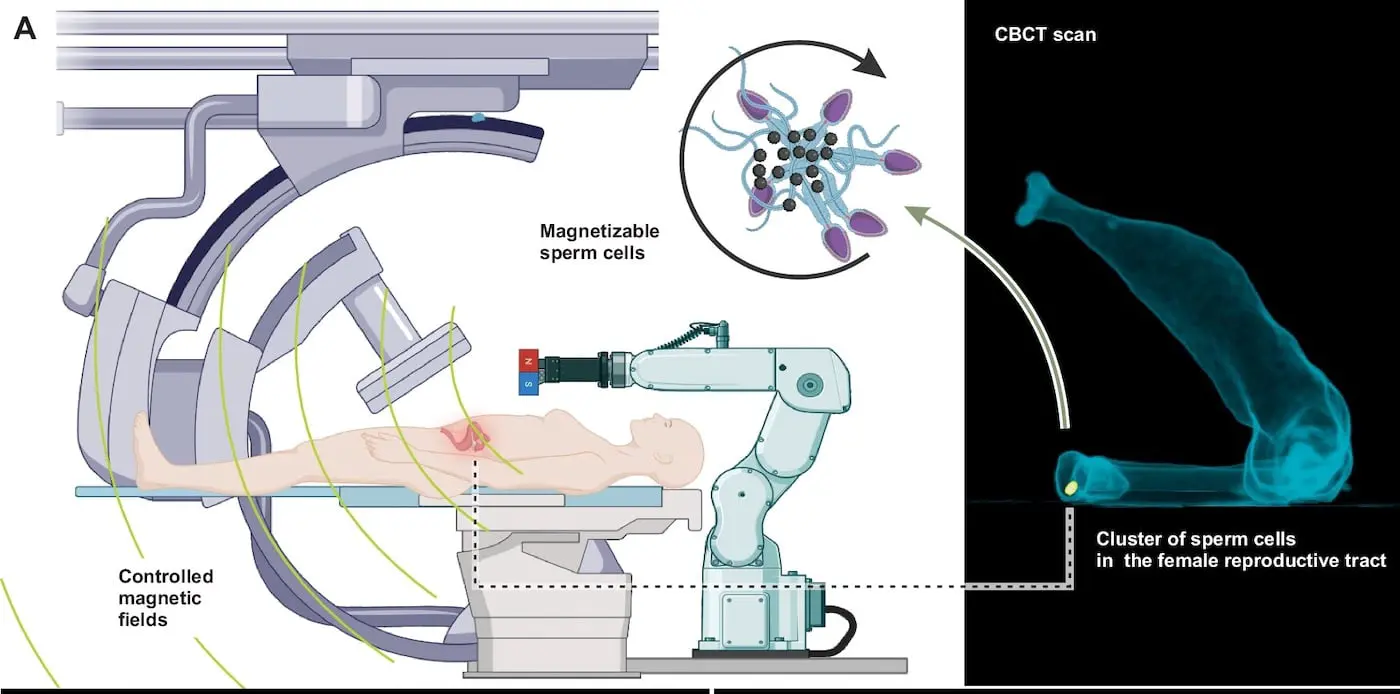
Ситуацию изменила идея объединить сперматозоиды с наночастицами оксида железа. Такая комбинация придала клеткам новые свойства — их стало возможно не только контролировать с помощью внешнего магнитного поля, но и отслеживать при помощи рентгеновских технологий. Ученые применили электростатическое самособирание: сперматозоиды группировались в небольшие кластеры, которые затем покрывались мельчайшими частицами железа. Эти наночастицы придают микроагрегатам двойную функциональность: они делают клетки магнитно-ответственными и увеличивают их плотность для эффективного рентгеновского контрастирования.
Полученные микророботы погрузили в созданную по анатомическим параметрам жидкостную модель женской репродуктивной системы, напечатанную на 3D-принтере. Теперь возможно не только направлять движения этих уникальных роботов, но и в любой момент наблюдать их путь по внутренним структурам.
Технология управления движением биороботов
Для движения и навигации гибридных кластеров использовался сложный манипулятор с постоянным магнитом. Он формирует вращающееся магнитное поле, благодаря чему группа связанных сперматозоидов аккуратно катится по внутренним каналам модели — от шейки и через полость матки, до маточных труб. Такой подход впервые позволяет совместить четкое управление микророботами и их наблюдение рентгеном в реальном времени, что является настоящим техническим прорывом.
Во время экспериментов достижима управляемость и высокая скорость перемещения кластеров. Под действием увеличения частоты вращения магнитного поля до 10 герц микророботы способны двигаться со скоростью 8–12 миллиметров в секунду и преодолевать всю анатомическую модель менее чем за минуту. Однако стоит отметить, что дальнейшее увеличение частоты может приводить к распаду кластеров на отдельные части, что требует дальнейших инженерных улучшений.
Проверка безопасности: биосовместимость и визуализация
Один из самых важных моментов — биосовместимость новых микророботов. Проводились опыты, в рамках которых кластеры контактировали с культурами человеческого эндометрия на протяжении 72 часов. Анализы убедительно показали, что жизнеспособность клеток оставалась высокой, в пределах от 74 до 88%. Это подтверждает безопасность такого метода для окружающих тканей, что особенно важно для применения в чувствительных областях, таких как женская репродуктивная система.
Кроме этого, ученые испытали разные концентрации магнитных наночастиц — один, два и три миллиграмма на миллилитр. Все эти дозировки оказались оптимальными для стабильно хорошей визуализации кластеров при рентгеновских исследованиях и эффективного управления их движением.
Будущее лечебных микророботов: перспективы и ограничения
Исследование продемонстрировало, что микророботы на основе сперматозоидов и наночастиц железа потенциально могут стать революционной технологией для точечного введения препаратов прямо к очагу заболевания, например при лечении эндометриоза, миомы или даже опухолей внутренних женских половых органов. Контролируемое направление движения и хорошая заметность делают платформу очень перспективной для решения актуальных медицинских задач без опасных инвазивных процедур.
Однако в настоящее время речь идет только о лабораторных моделях — реальные ткани организма куда сложнее, чем напечатанная на 3D-принтере пластиковая копия. В живом теле условия будут меняться за счет наличия иммуной системы, сложных жидкостных потоков и мягкости тканей. Пока микророботы испытывают тенденцию к распаду кластеров на отдельных участках пути, что также ограничивает эффективность технологии.
Оптимистичный взгляд в будущее технологий
Несмотря на начальный уровень разработки, результаты исследований позволяют с оптимизмом смотреть на будущее применения микророботов на основе сперматозоидов и наночастиц оксида железа. Развитие технологий управления магнитными полями, увеличение биосовместимости и наработка опыта экспериментальной работы с живыми тканями способны уже в ближайшие годы приблизить мечты о точной таргетной доставке лекарств к реальности.
Впереди — этапы усовершенствования прототипов, испытания в условиях, близких к реальным, и тщательные проверки безопасности. В итоге, использование естественных клеток, наделенных новыми технологическими возможностями, может подарить медицине эффективные, щадящие инструменты для спасения миллионов жизней. Опираясь на огромный природный потенциал сперматозоидов и современные нанотехнологии, исследователи прокладывают дорогу в эру интеллектуальных микророботов будущего.
Источник: naked-science.ru